길리어드사이언스코리아의 코로나19 치료제 렘데시비르는 지난해 7월 24일 식품의약품안전처로부터 허가를 받았다. 정식 명칭은 '베클루리주정맥주사용동결건조분말(렘데시비르)'이다.
렘데시비르는 뉴클레오시드 리보핵산(ribonucleic acid / RNA) 중합효소 억제제다. 아데노신 뉴클레오티드 전구약물로 세포 내에서 대사되어 약리학적으로 활성인 뉴클레오시드 삼인산 대사체를 형성한다.
주된 기전은 렘데시비르 삼인산이 아데노신 삼인산(adenosine triphosphate, ATP)의 유사체로 작용한다는 것이다. 즉 코로나19 바이러스(SARS-CoV-2) RNA의 의존적 RNA 중합효소(RdRP / RNA dependant RNA Polymerase)에 의해 신생 RNA 사슬에 편입하기 위해 자연 ATP 기질과 경쟁하는 기전을 가진다. 이는 바이러스 RNA 복제 중 사슬형성 종료를 지연시키는 효과를 나타낸다.
일반적으로 렘데시비르 삼인산은 포유류 DNA와 RNA 중합효소의 약한 억제제로, 미토콘드리아 독성 잠재력은 낮은 것으로 알려졌다.
렘데시비르의 적응증은 PCR 검사 등을 통해 코로나19가 확진된 환자로서, 아래 사항 중 어느 하나 이상에 해당하는 중증의 입원 환자의 치료라 할 수 있다.
실내공기(room air)에서 산소포화도(SpO2) 94% 이하인 환자, 보조산소 치료가 필요한 환자, 비침습적 또는 침습적 기계환기나 체외막산소요법(ECMO)이 필요한 환자가 대상이다.
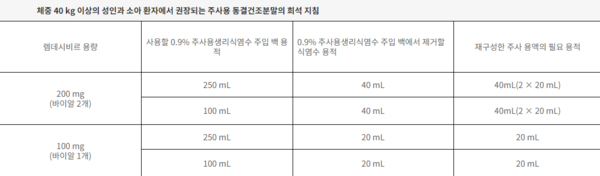
허가사항 상의 권장 투여 용량은 성인 기준 첫째 날 200 mg 투여(부하용량) 후, 둘째 날부터 100 mg 투여(유지용량)이다.
또 투여 기간은 침습적 기계환기나 체외막산소요법(ECMO)이 필요한 환자에서의 권장 투여기간은 10일이며, 침습적 기계환기나 체외막산소요법(ECMO)이 필요하지 않은 환자에서는 권장 투여기간을 5일로 하고, 5일 투여 후 임상 증상이 개선되지 않는 경우 추가로 5일간 투여(유지용량)할 수 있다.
다만 허가사항 상 전체 투여 기간은 10일 이내로 한다는 점이 명시되어 있다.
투여 방법은 일반적인 성인 기준 30분에서 120분에 걸쳐 1일 1회 점적 정맥 투여(IV infusion)다. 또 조제한 희석액은 다른 정맥주사 약물과 동시에 투여하지 않는다. 이 약과 0.9% 주사용생리식염수 이외의 다른 정맥투여 용액과의 적합성은 확인되지 않았다.
렘데시비르의 사용상의 주의사항에는 '이 약의 임상정보는 제한적이다. 이전에 보고되지 않은 예상하지 못한 중대한 이상반응이 발생할 수 있으므로 이 약을 투여 받는 환자에 대한 임상적, 실험실적 모니터링을 주의 깊게 실시한다.'는 점이 명시되어 있다.
또 이 약을 투여 받는 동안 혈청화학검사(serum chemistry), 혈액학검사(hematology), ALT, AST, 빌리루빈, ALP, 신기능검사(크레아티닌, 크레아티닌 청소율) 등 실험실적 검사를 매일 실시하도록 경고하고 있다.
또 렘데시비르는 급성 신장애 및 간장애를 유발할 수 있으므로, 투여 전 및 투여 기간 중 신기능 및 간기능을 면밀히 모니터링할 필요가 있으며, 주입연관반응(저혈압, 구역, 구토, 발한, 진전 등)이 나타날 수 있다는 점이 경고되고 있다.
투여가 제한되는 환자는 렘데시비르의 구성 성분(유효성분 : 렘데시비르 / 첨가제 : 수산화나트륨,염산,설포부틸에테르-베타-사이클로덱스트린 나트륨)에 과민증이 있는 경우다.
렘데시비르의 주된 이상반응은 ALT와 AST의 상승이다. 건강한 시험대상자와 PCR 검사로 확진된 코로나19 입원 환자에서 ALT와 AST의 상승은 제 1일에 이 약 200mg을 부하 용량으로 투여하고, 최대 9일 동안 1일 1회 100mg 투여 시 관찰됐다. 간수치 상승에 대한 기전은 확인되지 않았다.
때문에 잠재적인 이상반응을 조기에 발견할 수 있도록 이 약을 투여받는 환자에 대해 임상적 관찰과 실험실적 검사를 통한 모니터링을 실시하는 것이 중요하다.
이상반응이 발생했을 때, 이 약의 투여를 지속할 것인지 중단할 것인지에 대해서는 환자 개인의 임상적 위해성과 유익성의 평가를 통해 결정한다.
이 약에 대한 약물상호작용시험은 수행되지 않았다.
또 사람에서 렘데시비르가 모유를 통해 배출되는지 여부는 확인되지 않았으나, 동물에서는 렘데시비르를 투여받은 모체로부터 수유를 받은 새끼에서 렘데시비르 및 대사체가 검출됐으며, 이는 렘데시비르가 모유로 이행했기 때문일 가능성이 높다.
시험관 내 시험 결과, 렘데시비르는 CYP2C8, 2D6, 3A4의 기질이며 CYP3A4의 저해제이다. 또 OATP1B1과 P-gp의 기질이며 OATP1B1, 1B3, BSEP, MRP4, NTCP의 저해제이다.
매경헬스에 여러분의 이야기를 들려주세요.
억울한 혹은 따뜻한 사연을 24시간 기다립니다.
이메일 jebo@mkhealth.co.kr 대표전화 02-2000-5802 홈페이지 기사제보